Seznam hrazených indikací pembrolizumabu v léčbě mNSCLC – v monoterapii a kombinaci s chemoterapií:
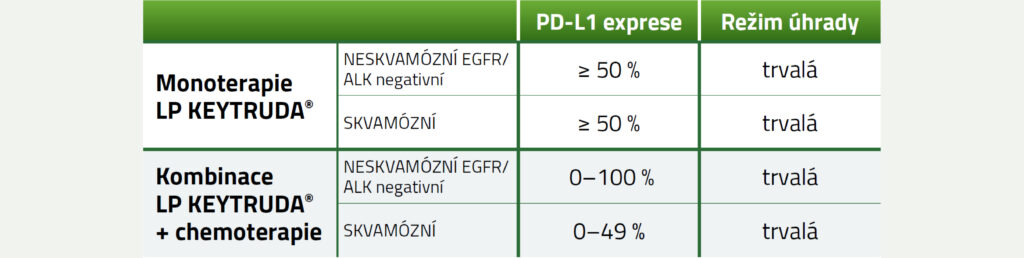
Pembrolizumab je u NSCLC hrazen:
1. v monoterapii v první linii k léčbě metastazujícího metastazujícího nemalobuněčného karcinomu plic (NSCLC) u dospělých pacientů (nádorové elementy exprimují PD-L1 s TPS ≥ 50 %);
2. v kombinaci s chemoterapií pemetrexedem a platinou v 1. linii léčby dospělých pacientů s metastazujícím neskvamózním nemalobuněčným karcinomem plic;
3. v kombinaci s chemoterapií karboplatinou a paklitaxelem v 1. linii léčby dospělých pacientů s metastazujícím skvamózním nemalobuněčným karcinomem plic (nádorové elementy exprimují PD-L1 s TPS < 50 %).
Pro úhradu ve všech indikacích musí být kumulativně splněny následující podmínky (pokud není dále uvedeno jinak):
a) pacient má výkonnostní stav 0–1 dle ECOG;
b) pacient nevykazuje přítomnost klinicky aktivních mozkových metastáz anebo mozkové metastázy jsou adekvátně léčené;
c) u pacientů s neskvamózním NSCLC nebyly prokázány aktivační mutace EGFR ani přítomnost anaplastické lymfomové kinázy (ALK);
d) pacient nevykazuje přítomnost intersticiální plicní choroby (při použití v léčbě NSCLC);
e) pacient není dlouhodobě léčen systémovými kortikosteroidy v dávce prednisonu nad 10 mg denně (či odpovídajícím ekvivalentem) nebo jinou imunosupresivní léčbou;
f) pacient nemá diagnostikované závažné aktivní systémové autoimunitní onemocnění s výjimkou následujících onemocnění: diabetes mellitus I. typu, autoimunitní zánět štítné žlázy, kožní autoimunitní onemocnění (např. psoriáza, atopický ekzém, ložisková alopecie, vitiligo);
g) pacient má přijatelnou funkci ledvin a jater (hladina kreatininu je ≤ 1,5×ULN, hladina bilirubinu ≤ 1,5 ULN, u pacientů s Gilbertovým syndromem ≤ 3×ULN, hladina AST a ALT ≤ 3×ULN, v případě přítomnosti jaterních metastáz ≤ 5×ULN), a současně uspokojivé hodnoty krevního obrazu (hladina hemoglobinu ≥ 90 g/l, počet leukocytů ≥ 2,5×109/l, popřípadě počet leukocytů ≥ 2,0×109/l (při použití v léčbě NSCLC), počet neutrofilů ≥ 1,5×109/l, počet trombocytů ≥ 100×109/l).
Léčba je hrazena do potvrzení progrese onemocnění, verifikované opakovaným radiologickým vyšetřením v odstupu 4–8 týdnů z důvodu odlišného mechanismu účinku imuno-onkologické terapie.
Z prostředků veřejného zdravotního pojištění je v indikaci NSCLC hrazeno podání maximálně 35 cyklů léčby pembrolizumabem.
V případě nutnosti ukončení léčby jedné složky z podávané kombinace z důvodu její netolerance je možné pokračovat v podávání ostatních léčiv.
Kompletní podmínky úhrady pembrolizumabu naleznete na www.sukl.cz.
Reference
1. Podmínky úhrady LP Keytruda® v indikaci NSCLC na www.sukl.cz, sp.zn. SUKLS302038/2021.
2. SPC LP Keytruda® na www.sukl.cz.
© Copyright Merck Sharp & Dohme s.r.o., 2022. Všechna práva vyhrazena. Merck Sharp & Dohme s.r.o., Na Valentince 3336/4, 150 00 Praha 5, Česká republika, Tel.: +420 233 010 111, email: dpoc_czechslovak@merck.com, www.msd.cz
ZIP KEYTRUDA k nahlédnutí zde.
CZ-KEY-00852 (1.0), datum přípravy – červenec 2022






