Článek byl publikován ve vydání Acta medicinae Onkologie/Hematoonkologie. Zveřejněno se souhlasem časopisu Acta medicinae.
Souhrn: Mnohé léčebné postupy, které se osvědčily v léčbě pokročilých nádorových onemocnění, v adjuvantním postavení selhaly, což vysvětlujeme odlišným chováním nádorové buněčné populace v postavení solidní částečně nekrotické malignity a disperze jednotlivých nádorových buněk. I u nádorů ledvin v řadě studií léčebné postupy jak s podáním multikinázových inhibitorů, tak s imunoterapií v adjuvantním podání selhaly. Autor se v článku zabývá výsledky studie KEYNOTE-564, které však naznačují pozitivní výsledky.
Klíčová slova: karcinom ledvin, adjuvantní léčba, studie KEYNOTE-564
První pozitivní vlaštovkou se stala studie KEYNOTE-564. Jednalo se o studii fáze III, randomizovanou v poměru 1: 1, probandy byli nemocní se světlobuněčným renálním karcinomem s vysokým rizikem rekurence po nefrektomii, s nebo bez metastazektomie,
kteří byli léčeni adjuvantně pembrolizumabem 200 mg i. v. každé 3 týdny po 17 cyklů nebo placebem.
Hlavním cílem studie byl zjistit rozdíl v čase bez přítomnosti onemocnění – disease free interval (DFS), sekundárním cílem pak celkové přežití nemocných, stejně jako bezpečnost podání.
Vstupní kritéria do studie KEYNOTE-564
Histologicky potvrzený lokoregionální karcinom ledviny (renal cell carcinoma, RCC) se světlobuněčnou složkou se sarkomatoidními rysy nebo bez nich. Nemocní měli jeden z následujících znaků:
• RCC se středně vysokým rizikem;
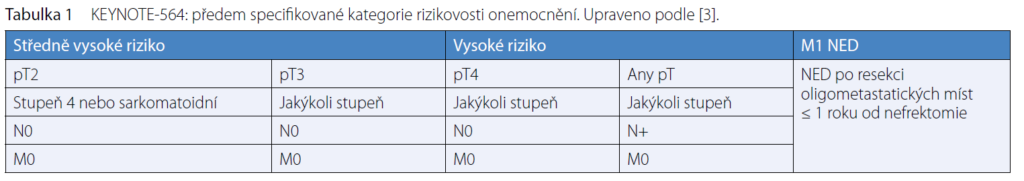
• pT2, stupeň 4 nebo sarkomatoidní varianta, N0 M0; pT3, jakýkoli stupeň, N0 M0;
• RCC s vysokým rizikem;
• pT4, jakýkoli stupeň, N0 M0; pT, jakékoli stadium, jakýkoli stupeň, N+ M0;
• M1 NED RCC.
Byla vyloučena předchozí systémová terapie pokročilého RCC, připuštěna částečná nefroprotektivní nebo radikální kompletní nefrektomie s negativními chirurgickými okraji, nefrektomie nebo metastezektomie s negativními chirurgickými okraji ≥ 28 dní před podpisem informovaného souhlasu a ≤ 12 týdnů před randomizací. Nemocní byli bez nádoru podle hodnocení zkoušejícího, výkonnostní stav ECOG PS 0–1, odpovídající funkce orgánů, předložen odpovídající vzorek nádoru k analýze biomarkeru.
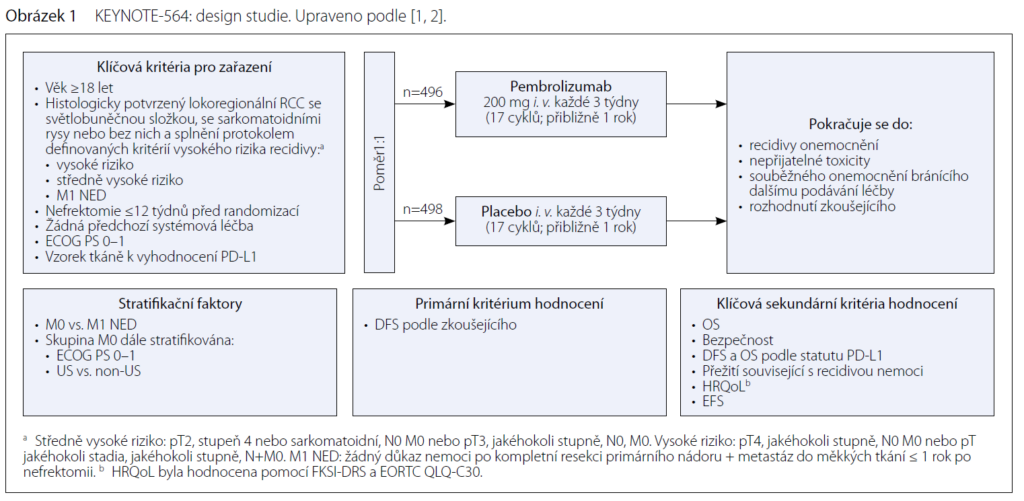
Vylučujícími kritérii byly předchozí terapie léčivem proti PD-1, PD-L1, PD-L2 nebo CTLA-4, předchozí protirakovinová léčba monoklonálními protilátkami, chemoterapie nebo hodnocené léčivo v průběhu 4 týdnů nebo 5 poločasů (podle toho, co je delší) před první dávkou léčby, předchozí radioterapie RCC, velký chirurgický zákrok během 12 týdnů před randomizací, předchozí nebo stávající dialyzační léčba, reziduální trombus po nefrektomii ve vena renalis nebo vena cava, další malignita, která progreduje nebo vyžadovala léčbu před ≤ 3 lety, metastatické léze v mozku nebo kostech, diagnóza imunodeficience nebo chronická systémová terapie steroidy (> 10 mg denně ekvivalentu prednisonu) nebo jakákoli imunosupresivní terapie během 7 dní před první dávkou hodnocené léčby. Aktivní autoimunitní onemocnění vyžadující systémovou léčbu během posledních dvou let; substituční terapie je povolena. Stávající pneumonitida nebo pneumonitida v anamnéze, HIV v anamnéze nebo aktivní infekce HBV nebo HCV, aktivní tuberkulóza v anamnéze nebo aktivní infekce vyžadující systémovou léčbu. Předchozí transplantace solidního orgánu.
Výsledky
Celkem 496 nemocných bylo randomizováno do ramene s pembrolizumabem,
498 jich dostávalo placebo. Pembrolizumab byl dávkován 200 mg i. v. každé 3 týdny po maximálně 17 cyklů. V interim analýze, kdy cut off byl včase 24,1 měsíce, dosáhl pembrolizumab významně delší DFS proti placebu, DFS ve 24 měsících 77,3 vs.
68,1 % u placeba, HR pro úmrtí: 0,68; 95% CI: 0,53–0 87; p = 0,002.
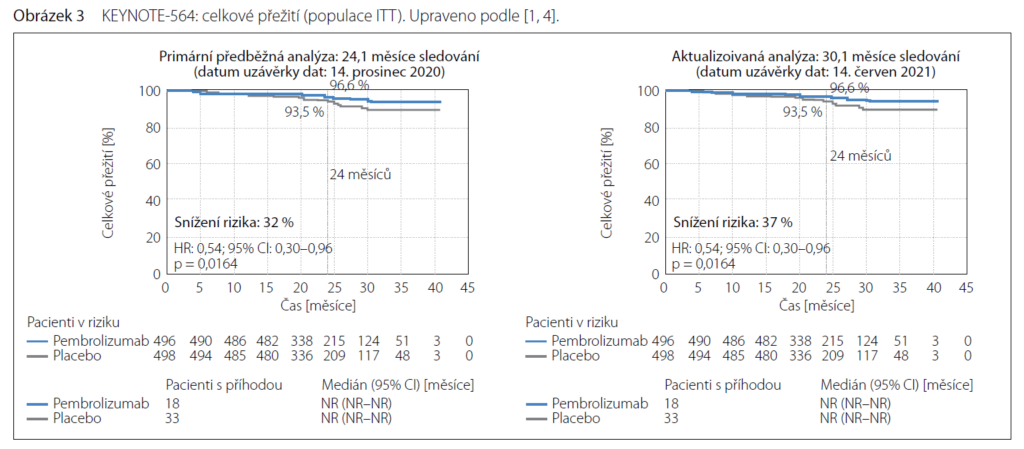
Odhadovaný počet nemocných přežívajících dva roky byl 96,6 % u nemocných na pembrolizumabu a 93,5 % v placebovém rameni. HR pro úmrtí bylo 0,54 (95% CI: 0,3–0,96). Stejné snížení rizika úmrtí o 46 % bylo dosaženo po sledování 30,1 měsíce.
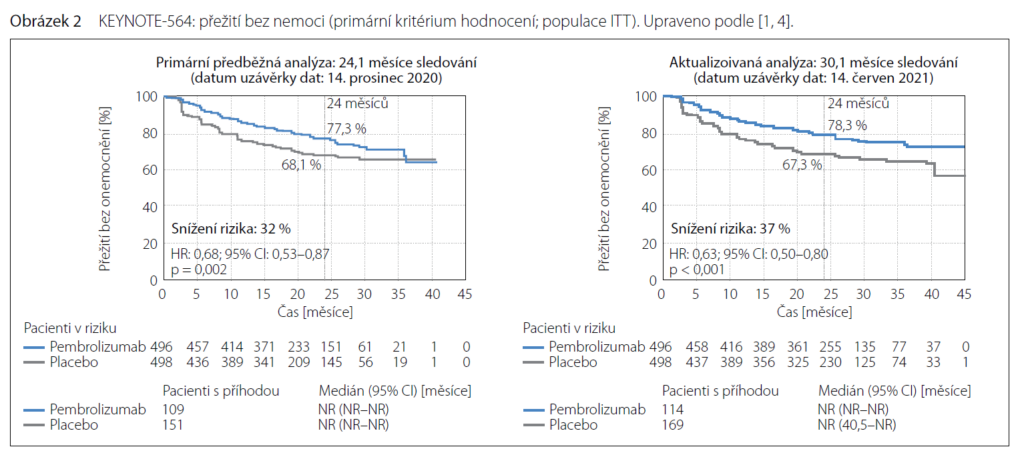
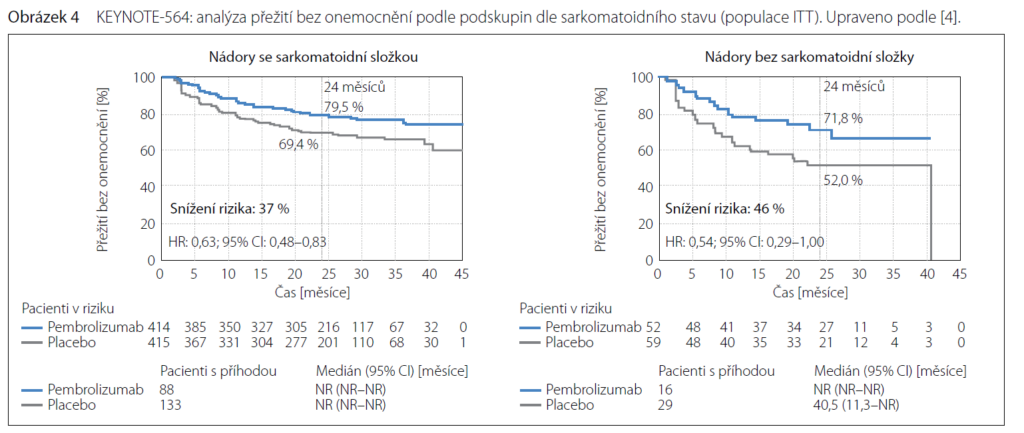
Bylo dosaženo snížení rizika znovuobjevení se onemocnění o 32 % v intermediate/high risk skupině, o 40 % v high risk skupině a o 71 % v M1 NED skupině. U nemocných bez sarkomatoidní varianty nádoru bylo snížení rizika o 37 %, s přítomností sarkomatoidní
složky o 46 %.
Nežádoucí účinky stupně 3 a vyššího jakéhokoli druhu byly zjištěny u 32,4 % nemocných na aktivní léčbě a u 17,7 % nemocných na placebu. Nebylo zaznamenáno žádné úmrtí v souvislosti s podáním pembrolizumabu. Lokální recidiva byla pozorována u 3,4 % (n = 17) pacientů ve skupině léčené pembrolizumabem a u 6,4 % (n = 32) pacientů ve skupině léčené placebem. Vzdálené recidivy byly pozorovány u 17,3 % (n = 86) pacientů ve skupině léčené
pembrolizumabem a u 23,5 % (n = 117) ve skupině s placebem. 76 pacientů ve skupině léčené pembrolizumabem a 112 pacientů ve skupině léčené placebem dostávalo následnou terapii.
Závěr
Studie KEYNOTE-564 přinesla jako první pozitivní výsledky léčby nemocných s vysoce rizikovým RCC v adjuvantním podání. Objevily se ihned spekulace, proč vyšla a jiné nikoli. Myslím, že vysvětlení je jednoduché – rozdílné skupiny nemocných ve studii, jiná potence zkoušených léků. Jedná se však o léčbu nemocných bez přítomnosti nádorové masy, onemocnění řady z nich by stejně neprogredovalo. Nelze proto přejímat výsledky studie KEYNOTE-564
bezhlavě, nutno poměřit u každého jednotlivého nemocného zvlášť riziko nežádoucích účinků a rizikovost onemocnění.
Jistými kandidáty adjuvantní léčby jsou nemocní se sarkomatoidní složkou nádoru a nemocní po metastazektomii, byť jich bylo ve studii málo. Vysoce rizikoví nemocní mají nyní novou šanci a na nás je, aby tato léčba byla těmto nemocným dostupná.
Zástupci České urologické společnosti ČLS JEP a České onkologické společnosti ČLS JEP vypracovali společné stanovisko k referování pacientů a možnosti adjuvantního podání imunoterapie pembrolizumabem u nemocných se světlobuněčným RCC. Na základě výsledků klinické studie KEYNOTE-564, ESMO Guidelines a Modré knihy ČOS ČLS JEP k adjuvantní léčbě RCC pomocí checkpoint inhibitorů vydala Uroonkologická sekce České onkologické společnosti ČLS JEP a Česká urologická společnost ČLS JEP doporučení pro referování pacientů s renálním karcinomem od pT2 G4 N0 M0 do komplexních onkologických center k individuálnímu
zhodnocení v rámci multidisciplinárního týmu.
Literatura na www.actamedicinae.cz/literatura
Kontakt: prof. MUDr. Jindřich Fínek, Ph.D. | Onkologická a radioterapeutická klinika FN a LF UK Plzeň | Alej Svobody 80, 304 60 Plzeň-Lochotín | e-mail: jindrich.finek@lfp.cuni.cz
1. Choueiri, T. K., et al.: Adjuvant pembrolizumab after nephrectomy in renal-cell carcinom. N Engl J Med, 2021, 385, s. 683–694.
2. Dostupné z: clinicaltrials.gov/ct2/show/NCT03142334, vyhledáno 25. 5. 2021.
3. Choueiri, T. K., et al.: Pembrolizumab versus placebo as post-nephrectomy adjuvant therapy for patients with renal cell carcinoma: Randomized, double-blind, phase III KEYNOTE-564 study. J Clin Oncol, 2021, 39, suppl. 18, DOI: 10.1200/JCO.2021.39.15_suppl. LBA5.
4. Choueiri, T. K. – Tomczak, P. – Park, S. H., et al.: Pembrolizumab as post nephrectomy adjuvant therapy for patients with renal cell carcinoma: Results from 30-month follow-up of KEYNOTE-564. Dostupné z: https://meetings.asco.org/abstracts-presentations/205370, vyhledáno 16. 8. 2023.
Copyright © 2023 Merck & Co., Inc., Rahway, NJ, USA a přidružené společnosti. Všechna práva vyhrazena. Merck Sharp & Dohme s.r.o., Na Valentince 3336/4, 150 00 Praha 5, Česká republika, IČ: 028462564, Tel.: +420 277 050 000,
e-mail: dpoc_czechslovak@merck.com, www.MSD.cz
ZIP KEYTRUDA k nahlédnutí zde.
CZ-JRC-00001 (1.0)., datum přípravy: říjen 2023




